
Mikrobiyom–Bağırsak–Davranış Ekseni: Bağırsak Mikrobiyomu ve Oligodendrositler Arasındaki Karşılıklı İletişim Davranışsal Tepkileri Ayarlar
Not: bu makalede beyin-bağırsak ilişkisi genel olarak işlenmiş olup konu sadece otizm ile sınırlı değildir.
Çevresel ve diyetsel uyaranlar her zaman beyin gelişimi ve davranışsal tepkilerle ilişkilendirilmiştir. Dış çevre ile iletişimin ana portalı olan bağırsak, son zamanlarda sağlık ve hastalıkta bağırsak-beyin ekseninin kurulmasıyla bu etkileşimin ön saflarına getirilmiştir. Ayrıca, mikropsuz ve antibiyotikle tedavi edilmiş farelerdeki son gelişmeler, farelerde davranışsal tepkileri modüle etmede mikrobiyomun önemli etkisini göstermiş ve daha spesifik bir mikrobiyom-bağırsak-davranış ekseni oluşturmuştur. Bu eksenin sosyal davranışı etkilediği mekanizmalardan biri, karmaşık bilişsel davranış planlaması ve karar verme için önemli bir bölge olan prefrontal kortekste miyelinasyonu düzenlemektir. Prefrontal korteks, insanlarda yaşamın üçüncü on yılına kadar uzayabilen ve onu mikrobiyal metabolitler gibi dış etkilere duyarlı hale getiren aksonal projeksiyonlarının geç miyelinasyonunu sergiler. Bağırsak mikrobiyomundaki değişikliklerin, oligodendrosit farklılaşmasını bozabilecek p-kresol gibi yüksek geçirgenliğe sahip biyoaktif bileşikleri etkileyen mikrobiyal metabolom bileşimini değiştirdiği gösterilmiştir. Prefrontal korteksteki düzensiz miyelinasyon daha sonra farelerde davranışsal tepkileri etkileyerek onları sosyal izolasyona doğru kaydırabilmektedir. Azalan sosyal etkileşimler daha sonra mikrobiyal alışverişi sınırlayabilir, aksi takdirde konakçıdaki mevcut mikrobiyal topluluğun hayatta kalması için bir tehdit oluşturabilir ve böylece belirli mikrobiyal topluluğa evrimsel bir avantaj sağlayabilir. Bu derlemede, mikrobiyom-bağırsak-davranış ekseni analiz edilmiş, bağırsak mikrobiyomu ile oligodendrositler arasındaki etkileşimler tanımlanmış ve sosyal davranışın modülasyonundaki rolleri vurgulanmıştır.
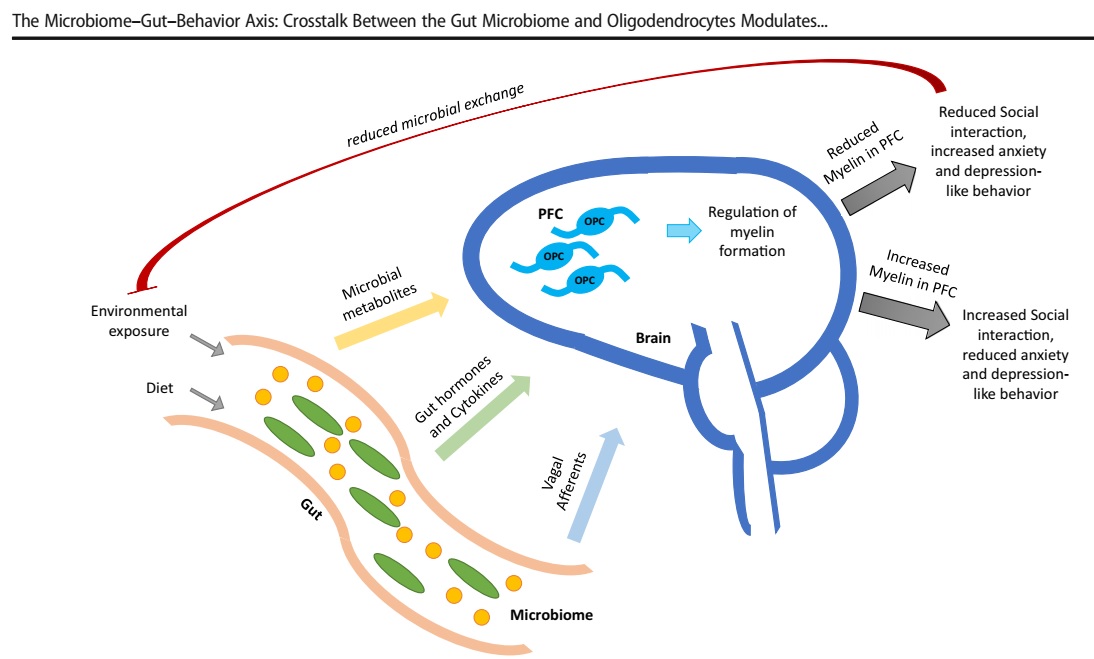
Şekil 1: Mikrobiyom-bağırsak-davranış ekseni. Bağırsak, memeli vücudunun çevresel maruziyetinin ana portallarından biridir ve bağırsak mikrobiyomunun, beyin gelişimi ve davranışına ulaşabilen ve etkileyebilen belirli ikincil haberciler üretmek için çevresel ve diyet sinyallerini bütünleştirdiği yerdir. Bu ikinci haberciler benzersiz mikrobiyal metabolitler, bağırsak hormonları, sitokinler ve vagal afferent sinyaller şeklinde olabilir. Bağırsak mikrobiyomu tarafından davranışsal tepkilerin modülasyonunun iyi çalışılmış bir mekanizması, muhtemelen Sox10 veya MYRF'yi modüle ederek beyne ulaşabilen ve muhtemelen oligodendrosit progenitör hücrelerinin (OPC) farklılaşmasına müdahale ederek beynin prefrontal korteksindeki (PFC) miyelin oluşumunu etkileyebilen belirli mikrobiyal metabolitleri içerir. Bağırsak mikrobiyal topluluğu tarafından bu metabolitlerin artan üretimi, OPC farklılaşmasını engelleyebilir ve PFC'de miyelin oluşumunu azaltabilir. PFC'de azalmış miyelinasyon daha sonra artan kaygı ve depresyon benzeri davranış ve azaltılmış sosyal etkileşim ile ilişkilidir. Bu sosyal izolasyon, daha az mikrobiyal değişime yol açabileceğinden, dış çevreden gelen rekabeti sınırlayarak mikrobiyal topluluğa fayda sağlayabilir. Bununla birlikte, bağırsak mikrobiyal topluluğu tarafından bu metabolitlerin üretiminin azalması, PFC'deki OPC'lerin farklılaşmasına ve miyelinizasyonun artmasına izin verecek, bu da en azından farelerde artan sosyal etkileşimlere ve azaltılmış kaygı ve depresif davranışlara yol açabilecektir.
Makalenin tam metnine aşağıdaki bağlantıdan ulaşabilirsiniz:
The Microbiome–Gut–Behavior Axis: Crosstalk Between the Gut Microbiome and Oligodendrocytes Modulates Behavioral Responses
Note: in this article, the brain-gut relationship is generally discussed and the subject is not limited to autism only.
Environmental and dietary stimuli have always been implicated in brain development and behavioral responses. The gut, being the major portal of communication with the external environment, has recently been brought to the forefront of this interaction with the establishment of a gut–brain axis in health and disease. Moreover, recent breakthroughs in germ-free and antibiotic-treated mice have demonstrated the significant impact of the microbiome in modulating behavioral responses in mice and have established a more specific microbiome–gut–behavior axis. One of the mechanisms by which this axis affects social behavior is by regulating myelination at the prefrontal cortex, an important site for complex cognitive behavior planning and decision-making. The prefrontal cortex exhibits late myelination of its axonal projections that could extend into the third decade of life in humans, which make it susceptible to external influences, such as microbial metabolites. Changes in the gut microbiome were shown to alter the composition of the microbial metabolome affecting highly permeable bioactive compounds, such as p-cresol, which could impair oligodendrocyte differentiation. Dysregulated myelination in the prefrontal cortex is then able to affect behavioral responses in mice, shifting them towards social isolation. The reduced social interactions could then limit microbial exchange, which could otherwise pose a threat to the survival of the existing microbial community in the host and, thus, provide an evolutionary advantage to the specific microbial community. In this review, we will analyze the microbiome–gut–behavior axis, describe the interactions between the gut microbiome and oligodendrocytes and highlight their role in the modulation of social behavior.

Fig. 1 The microbiome–gut–behavior axis. The gut is one of the major portals of environmental exposure of the mammalian body and is the site where the gut microbiome integrates the environmental and dietary signals to produce certain secondary messengers that can reach and affect brain development and behavior. These second messengers can be in the form of unique microbial metabolites, gut hormones, cytokines, and vagal afferent signals. One well-studied mechanism of modulation of behavioral responses by the gut microbiome involves certain microbial metabolites that can reach the brain and affect myelin formation in the prefrontal cortex (PFC) of the brain by interfering with differentiation of oligodendrocyte progenitor cells (OPC), possibly via modulating Sox10 or MYRF. Increased production of these metabolites by the microbial community of the gut can inhibit OPC differentiation and reduce the formation of myelin in the PFC. Reduced myelination in the PFC is then associated with increased anxiety and depression-like behavior and reduced social interaction. This social isolation could then benefit the microbial community by limiting incoming competition from the external environment, as social isolation could also lead to less microbial exchange. However, decreased production of these metabolites by the gut microbial community would allow OPCs in the PFC to differentiate and increase myelination, which could lead to increased social interactions, and reduced anxiety and depressive-like behaviors, at least in mice.
Full text:
https://link.springer.com/article/10.1007/s13311-017-0597-9


